Forschungsschwerpunkte
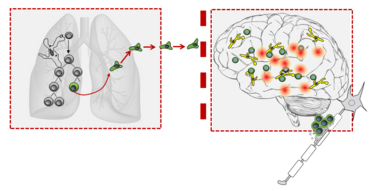
Im Allgemeinen wird angenommen, dass eine Autoimmunerkrankung des ZNS ein Prozess ist, der sich aus mehreren Schritten zusammensetzt. Verursacht wird die Erkrankung durch T-Zellen, die gegen das ZNS gerichtet sind. Diese kommen auch im Immunrepertoire gesunder Personen vor. Erst eine Aktivierung der Zellen in peripheren Organen ermöglicht es den T-Zellen, eine krankmachende Wirkung zu entfalten: die T-Zellen werden durch die Aktivierung befähigt, die Blut-Hirn-Schranke, die einen speziellen Schutzwall um das ZNS bildet, zu überwinden und in das Gewebe einzudringen. Dort rufen sie eine starke Entzündungsreaktion mit anschließender Schädigung des Nervengewebes hervor (Abb. 1)
Diese Abfolge von verschiedenen Schritten, die durch die Erforschung der Multiplen Sklerose im letzten Jahrzehnt immer weiter zu Tage getreten sind, unterstreicht, dass Autoimmunität des ZNS nicht als isolierter Konflikt zwischen dem Immunsystem und dem Nervensystem zu betrachten ist. Vielmehr handelt es sich um einen systemischen Prozess, der verschiedene Gewebe des Körpers umfasst. In all diesen verschiedenen Geweben müssen bestimmte Ereignisse stattfinden, damit es am Ende zu einer Schädigung des ZNS kommt.
Das Ziel meiner Arbeitsgruppe ist es, in der Abfolge der verschiedenen Ereignisse diejenigen zu identifizieren, die als entscheidende Kontrollpunkte fungieren und den T-Zellen einen Angriff des ZNS erlauben.
Speziell wollen wir folgende Fragen beantworten.
- Wo und wie werden T-Zellen in den peripheren Organen aktiviert?
- Wie verhalten sich T-Zellen an der Grenze zum ZNS?
- Welche Mechanismen sorgen für die Schäden in grauer oder weißer Substanz?
Schlüsseltechnologien
In meiner Arbeitsgruppe kombinieren wir moderne Mikroskopietechniken mit morphologischen und funktionellen Analysen, um das Verhalten und die Funktion ZNS-reaktiver T-Zellen zu untersuchen. Dabei verwenden wir ein Nagetiermodell für Multiple Sklerose, die Experimentelle Autoimmune Enzephalomyelitis.
Grundsätzlich unterscheiden sich T-Zellen von den meisten anderen Zellen eines adulten Organismus darin, dass sie die einzigartige Fähigkeit besitzen, sich frei zu bewegen und zwischen verschiedenen Organen und Körperregionen zu wandern. Diese Eigenschaft erlaubt es diesen Immunzellen, ihrer Schutzfunktion unter normalen Bedingungen nachzukommen, allerdings auch im Krankheitsfall in nahezu sämtlichen Organen unseres Körpers Schäden anzurichten, wie dies z.B. bei der Autoimmunität im ZNS der Fall ist. Deswegen muss man zum Verständnis von (Auto)Immunität auch die grundlegenden dynamischen Prozesse von Immunzellen betrachten.
Die Arbeitsgruppe hat sich in den letzten Jahren darauf spezialisiert, die komplexe Choreographie von T-Zellwanderungen und deren Funktion mit Hilfe von 2-Photonenmikroskopie in lebendem Gewebe aufzuzeichnen. Für tiefergehende morphologische Analysen verwenden wir konfokale und STED Mikroskopie. Die funktionelle Charakterisierung der Zellen erfolgt über verschiedene Techniken: mRNA Analyse mit quantitativer PCR und Transkriptomsequenzierung, Analyse von Proteinexpression mit Durchflusszytometrie.
Projekte
Die Rolle der Lunge bei der Autoimmunität im ZNS
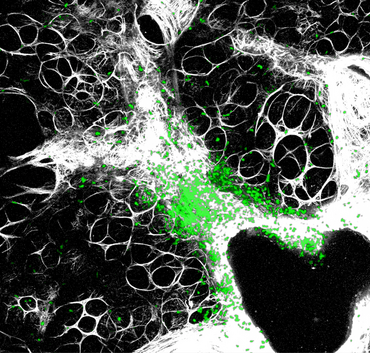
Eine entscheidende Frage in der Neuroimmunologie ist, wo und wie ruhende ZNS-reaktive T-Zellen in der Peripherie aktiviert werden. In unseren vorherigen Studien entdeckten wir, dass die Lunge hierbei eine wichtige Rolle spielen könnte (Odoardi et al. 2012). Die Lunge steht mit der äußeren Umwelt in ständiger Kommunikation und ist mit einem spezialisierten Immunsystem und einem eigenen Mikrobiom ausgestattet. Wir fanden heraus, dass ZNS-reaktive T-Zellen vor dem Eindringen in das ZNS die Lunge ansteuern, wo sie umfassend modifiziert werden (Abb. 2). Dabei verändern sich ihre charakteristischen Bewegungsmuster und ihr Genexpressionsprofil, was den T-Zellen erlaubt die Blut-Hirn-Schranke zu überwinden und in das Nervengewebe einzudringen. Zurzeit untersuchen wir, ob die Lunge auch als Auslöser für Autoimmunität im ZNS fungieren kann und ob das lokale Milieu der Lunge diesen Prozess beeinflusst.
Das Verhalten von Immunzellen an der Grenze zum ZNS
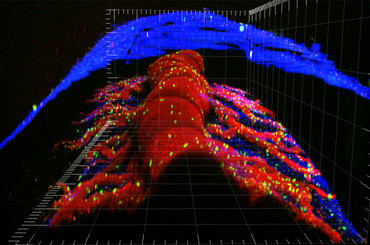
Das ZNS wird von den sogenannten Hirnhäuten (Meningen) ummantelt. Die Meningen bestehen aus drei dünnen Gewebeschichten; Dura mater, Arachnoidea und Pia mater, und schirmen das ZNS nach außen hin ab (Abb. 3). In der Experimentellen Autoimmunen Enzephalomyelitis spielen die Meningen eine wichtige Rolle, u.a. bei der Initiierung des Autoimmunprozesses. Wir zeigen, dass die Meningen als Eintrittspforte für T-Zellen in das ZNS dienen und einen wichtigen Kontrollpunkt für die lokale T-Zellaktivierung darstellen (Bartholomäus et al. 2009, Schläger et al. 2016). Zurzeit untersuchen wir die physikalischen, zellulären und molekularen Mechanismen, die es T-Zellen, sich an das Endothel der meningealen Blutgefäße anzuheften und in das ZNS-Gewebe einzuwandern. Außerdem wollen wir verstehen, ob und wie eine meningeale Entzündung zu einer Schädigung des Nervengewebes führen kann.
Mechanismen der Zellschädigung
Bei Multipler Sklerose kommt es zu herdförmigen, entmarkenden Läsionen in der weißen Substanz. Jedoch ist, auch schon im Anfangsstadium der Erkrankung, die graue Substanz ebenfalls betroffen. Dabei scheinen die Schäden in der grauen Substanz eine deutlich größere Rolle bei der Entstehung von funktionellen und kognitiven Beeinträchtigungen zu spielen. Zurzeit sind die Mechanismen, die für die Entstehung der Schäden in der grauen oder weißen Substanz verantwortlich sind, noch nicht ausreichend verstanden. Vor kurzem konnten wir in einem tierexperimentellen Modell zeigen, dass autoreaktive T-Zellen, die gegen neuronale Strukturen gerichtet sind, ein starke Entzündung und Schädigung der grauen Hirnsubstanz auslösen (Lodygin et al. 2019). Dieses Modell ist deshalb so wichtig, weil die meisten herkömmlichen Tiermodelle fast ausschließlich nur in die weiße Substanz schädigen (Abb. 4). Zurzeit erforschen wir die genauen Mechanismen, die bei der Schädigung der grauen und weißen Substanz eine Rolle spielen.
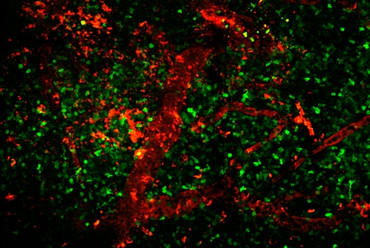
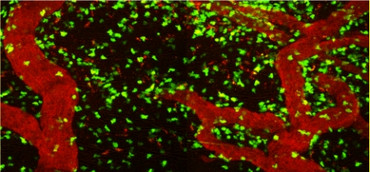
Abb. 4: Räumliche Verteilung Neuronen- (TbSYN) oder Myelin-spezifischer (TMBP) T-Zellen im Gehirn, respektive Spinalmark. Zweiphotonen-Fluoreszenzmikorskopie.
Kontakt

Kontaktinformationen
- Telefon: +49 551 3961139
- E-Mail-Adresse: francesca.odoardi(at)med.uni-goettingen.de
Relevante Publikationen
Hosang L, Löhndorf A, Dohle W, Rosche A, Marry S, Diercks B-P, Müller-Kirschbaum LC, Flügel LT, Potter BVL, Odoardi F, Guse AH*, Flügel A*.
2-Methoxyestradiol-3,17-O,O-bis-sulfamate inhibits store-operated Ca2+ entry in T lymphocytes and prevents experimental autoimmune encephalomyelitis.
Biochim Biophys Acta Mol Cell Res (2023), 1870: 119485. doi: 10.1016/j.bbamcr.2023.119485. *equal contribution. PMID 37150482.
Merlini A, Haberl M, Strauß J, Hildebrand L, Genc N, Franz J, Chilov D, Alitalo K, Flügel-Koch C, Stadelmann C, Flügel A*, Odoardi F*
Distinct roles of the meningeal layers in CNS autoimmunity.
Nat Neurosci (2022), 25: 887-899. doi: 10.1038/s41593-022-01108-3. *equal contribution. PMID 35773544.
Hosang L, Cugota Canals R, van der Flier FJ, Hollensteiner J, Daniel R, Flügel A* and Odoardi F*
The lung microbiome regulates brain autoimmunity.
Nature (2022), 603: 138-144. doi: 10.1038/s41586-022-04427-4. *equal contribution. PMID 35197636.
Lodygin D+, Hermann M+, Schweingruber N, Flügel-Koch C, Watanabe T, Schlosser C, Merlini A, Körner H, Chang H-F, Fischer HJ, Reichardt HM, Zagrebelsky M, Mollenhauer B, Frahm J, Stadelmann C, Kügler S, Fitzner D, Haberl M, Odoardi F* & Flügel A*+equal contribution, * co-senior authors
β-Synuclein reactive T cells induce autoimmune CNS grey matter degeneration.
Nature, 566: 503-508. PMID 30787438.
Schläger C, Körner H, Krueger M, Vidoli S, Haberl M, Mielke D, Brylla E, Issekutz T, Cabañas C, Nelson PJ, Ziemssen T, Rohde V, Bechmann I, Lodygin D, Odoardi F, Flügel A.
Effector T-cell trafficking between the leptomeninges and the cerebrospinal fluid.
Nature 530 (2016): 349-353.
Lodygin D, Odoardi F, Schläger C, Körner H, Kitz A, Nosov M, van den Brandt J, Reichardt HM, Haberl M, Flügel A.
A combination of fluorescent NFAT and H2B sensors uncovers dynamics of T cell activation in real time during CNS autoimmunity.
Nat Med 19 (2013): 784-790.
Odoardi F, Sie C, Streyl K, Ulaganathan VK, Schläger C,Lodygin D, Heckelsmiller K, Nietfeld W, Ellwart J, Klinkert WE, Lottaz C, Nosov M, Brinkmann V, Spang R, Lehrach H, Vingron M, Wekerle H, Flügel-Koch C, Flügel A.
T cells become licensed in the lung to enter the central nervous system.
Nature 488 (2012): 675-679
C. Cordiglieri, F. Odoardi, B. Zhang, M. Nebel, N. Kawakami, W.E.F. Klinkert, D. Lodygin, F. Lühder, E. Breunig, D. Schild, V. Kumar, K. Dornmair, W. Dammermann; B.V.L. Potter, A.H. Guse, A. Flügel.
NAADP-mediated Ca2+ signaling in effector T cells regulates autoimmunity of the nervous system.
Brain 133 (2010): 1930-43.
I. Bartholomäus, N. Kawakami, F. Odoardi, C. Schläger, D. Miljkovic, J.W. Ellwart, W.E. Klinkert, T.B. Issekutz, C. Flügel-Koch, H. Wekerle, A. Flügel.
Effector T cell interactions with meningeal vascular structures in nascent autoimmune CNS lesions.
Nature 462 (2009):94-8.
N. Müller, J. van den Brandt, F. Odoardi, D. Tischner, J. Herath, A. Flügel, H.M. Reichardt.
CD28 superagonistic antibodies elicit two functionally distinct waves of T cell activation.
Journal of Clinical Investigation 118(2008):1405-1416.
F. Odoardi, N. Kawakami, W.E.F. Klinkert, H. Wekerle, A. Flügel.
Blood-born soluble protein antigen intensifies T cell activation in autoimmune CNS lesions and exacerbates clinical disease.
Proceedings of the National Academy of Sciences of the United States of America 104 (2007): 18625-18630.
F. Odoardi, N. Kawakami, Z. Li, C. Cordiglieri, K. Streyl, M. Nosov, W.E.F. Klinkert, J.W. Ellwart, J. Bauer, H. Lassmann, H. Wekerle, A. Flügel.
Instant effect of soluble autoantigen on effector T cells in peripheral immune organs during immunotherapy of autoimmune encephalomyelitis.
Proceedings of the National Academy of Sciences of the United States of America 16 (2007): 920-25.
N. Kawakami, F. Odoardi, T. Ziemssen, M. Bradl, T. Ritter, O. Neuhaus, H. Lassmann, H. Wekerle, A. Flügel.
Autoimmune CD4+ T cell memory: Life long persistence of encephalitogenic T cell clones in healthy immune repertoires.
Journal of Immunology, 175 (2005):69-81.
N. Kawakami, U.V. Nägerl, F. Odoardi, T. Bonhoeffer, H. Wekerle, A. Flügel.
Live imaging of effector cell trafficking and autoantigen recognition within the unfolding autoimmune encephalomyelitis lesion.
Journal of Experimental Medicine, 201 (2005): 1805-14.
N. Kawakami, S. Lassmann, Z. Li, F. Odoardi, T. Ritter, T. Ziemssen, W.E.F. Klinkert, J.W. Ellwart, M. Bradl, K. Krivacic, H. Lassmann, R.M. Ransohoff, H-D. Volk, H. Wekerle, C. Linington, A. Flügel.
The activation status of neuroantigen-specific T cells in the target organ determines the clinical outcome of autoimmune encephalomyelitis.
Journal of Experimental Medicine 199 (2004): 185-197.
