Forschungsschwerpunkte
Bei der Entstehung der Multiplen Sklerose spielen autoreaktive T-Zellen eine entscheidende Rolle. Unser Forschungsschwerpunkt liegt auf dem Wanderungsverhalten von T-Zellen durch den Körper, ihrer Reaktivierung im Zentralnervensystem und der durch T-Zellen vermittelten Schädigung des Gewebes durch Entzündungsreaktionen. Unser Ziel ist es außerdem, bessere Tiermodelle zu entwickeln, die neueste genetische Werkzeuge beinhalten. Das würde uns erlauben, die verschiedenen Aspekte von humanen Autoimmunerkrankungen des ZNS besser zu erforschen und nach neuen Therapieansätzen zu suchen.
Schlüsseltechnologien
Genetische Manipulation von T-Zelllinien durch Retroviren
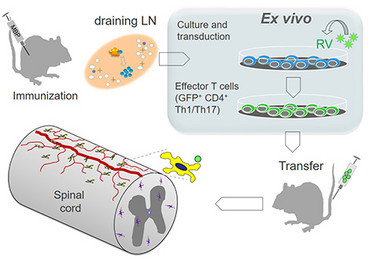
Ein großer Vorteil des „adoptive transfer EAE“ Modells liegt darin, dass man die hierbei verwendeten T-Zellen durch retrovirale Transduktion genetisch verändern kann. Dabei können z.B. fluoreszente Proteine oder andere Gene stabil oder transient in T-Zellen einer bestimmten Spezifität exprimiert werden. Unsere Effektor-T-Zelllinien etablieren wir durch Immunisierung von Lewis Ratten mit einem bestimmten Antigen (z.B. Myelin basisches Protein, MBP) und Entnahme der drainierenden Lymphknoten. Aus diesen isolieren wir MBP-spezifische T-Zellen und stimulieren und expandieren diese in Kultur durch Zugabe von Antigen. Hierbei findet auch die retrovirale Transduktion statt. Diese T-Zellen werden danach wieder in Ratten transferiert und infiltrieren nach ein paar Tagen das Rückenmark ZNS der Tiere und rufen eine Entzündung im ZNS des Gewebes hervor. Dabei können die T-Zellen mit Hilfe von verschiedenen Methoden analysiert werden, z.B. mit Durchflusszytometrie, Histologie oder 2-Photonenmikroskopie.
Transfer EAE
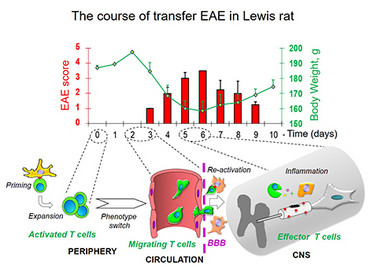
In der Lewis Ratte kann die passive autoimmune EnzephalomyelitisTransfer-EAE durch Transfer vonÜbertragung aktiviertern T-Zellen spezifisch für Myelinantigene (z.B. MBP) ausgelöst werden. Der klinische Verlauf der EAE zeigt sich in aufsteigenden Lähmungen und ist monophasisch. Dabei folgt auf eine Initialperiode ohne Symptome eine autoimmune Attacke des ZNS mit anschließender vollkommener Erholung der Tiere.
Generierung von transgenen Ratten
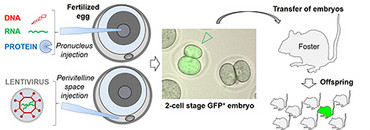
Das Nagetiergenom kann im embryonalen Einzellstadium durch Mikroinjektion manipuliert werden. Dabei können Nukleinsäuren und Proteine durch eine Injektion in den Pronukleus transferiert werden. Alternativ können Expressionskonstrukte in lentivirale Partikel verpackt und in den Perivitellinraum des Embryos injiziert werden. Nach der Injektion werden die Embryos im Zweizellstadium in scheinschwangere Weibchen übertragen. Der Nachwuchs wird dann auf Integration des Transgens und der Expression des gewünschten Proteins hin untersucht und zur weiteren Zucht verwendet. Diese Technik kann dazu verwendet werden, ein Transgen (z.B. GFP-TZRtg) zufällig in das Genom zu integrieren oder einen spezifischen Lokus mit Hilfe der CRISPR/Cas9 Technik gezielt zu manipulieren.
Projekte
Aktivierung von T-Zellen im ZNS
Zur Aktivierung von CD4+ T-Lymphozyten wird die Hilfe von Antigen präsentierenden Zellen (APCs) benötigt. Das können z.B. dendritische Zellen oder Makrophagen sein. APCs nehmen Antigene aus ihrer Umgebung auf, verdauen diese zu Peptiden und präsentieren diese Peptide gebunden an MHC-Klasse-II Moleküle auf ihrer Zellmembranoberfläche. Die Bindung des T-Zellrezeptors (TZR) an diese Peptid-MHC Komplexe setzt in den T-Zellen eine Kaskade von Phosphorylierungen in Gang (z.B. Lck, Zap70, LAT) und führt zur Aktivierung von Phospholipase C (PLCγ). Letztere bewirkt die Ausschüttung intrazellulären Ca2+ aus dem endoplasmatischen Retikulum (ER) und es erfolgt ein Einstrom von Ca2+ aus dem Extrazellulärraum in das Zytosol der Zelle durch CRAC Kanäle in der Plasmamembran. Der erhöhte Kalziumspiegel im Zytosol der T-Zelle aktiviert die Phosphatase Calcineurin, welche das Protein NFAT (nuclear factor of activated T cells) dephosphoryliert. Dadurch wird NFAT in den Zellkern transloziert und bindet dort an spezifische Promotoren um die Transkription von Zielgenen zu aktivieren (z.B. IL-2, IFNγ). Diese Gene sind essentiell für die Differenzierung von T-Zellen und die Ausübung ihrer Effektorfunktionen.
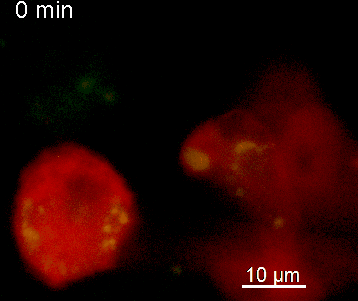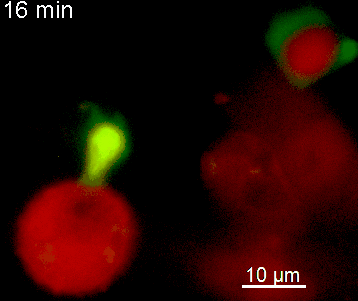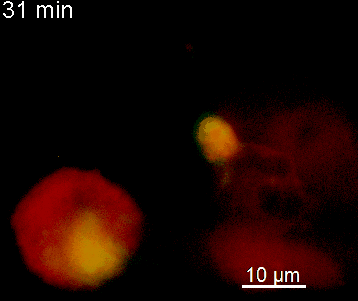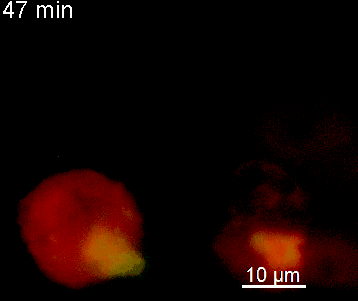
Der N-terminale Teil von NFAT gekoppelt an ein fluoreszentes Protein kann durch retrovirale Transduktion in Effektor-T-Zellen exprimiert werden. Dadurch ist es möglich, den Aktivierungsprozess mit Hilfe eines Fluoreszenzmikroskops durch Aufnahme von Zeitrafferaufnahmen live zu verfolgen (Animation 1). Im Video werden dendritische Zellen (in rot) gezeigt, die aus dem Knochenmark eines RFP-transgenen Tieres isoliert wurden. Diese werden dazu verwendet, MBP-spezifischen TNFAT-YFP/CherryH2B Zellen MBP-Peptide zu präsentieren. Der Kontakt einer T-Zelle mit einer Antigen-präsentierenden Zelle (APC) induziert eine sofortige Translokation von NFAT in den Zellkern (gelb).
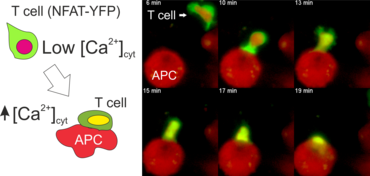
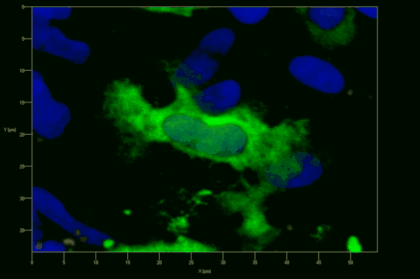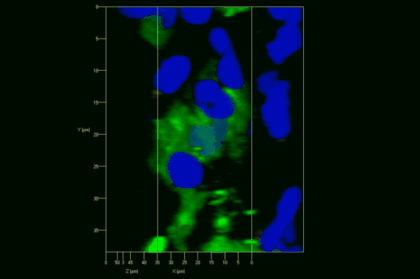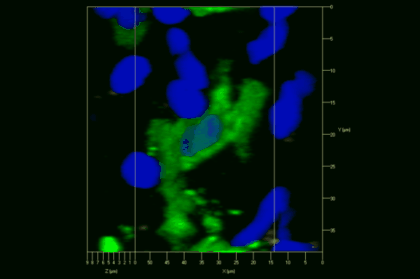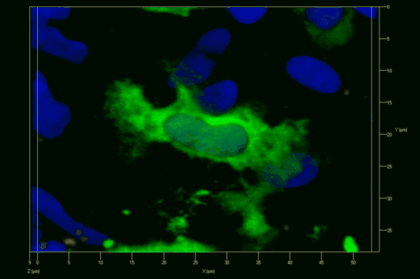
Meningeale und perivaskuläre Makrophagen sind die ersten APCs, auf die T-Zellen nach dem Überqueren der Blut-Hirn-Schranke und dem Eintritt in den perivaskulären/meningealen Raum treffen. Diese Zellen sind myeloiden Ursprungs und können mit Hilfe von Knochenmarkchimären (durch Rekonstitution mit GFP-exprimierenden hämatopoetischen Stammzellen) sichtbar gemacht werden (Animation 2 & 3). Im Gegensatz zu Mikroglia exprimieren die meningealen und perivaskulären Makrophagen eine hohe Anzahl an MHC-Klasse-II Molekülen auf ihrer Oberfläche.
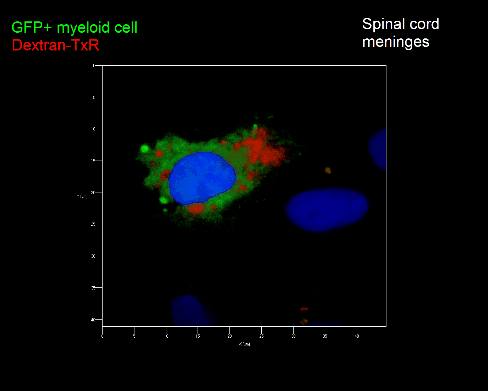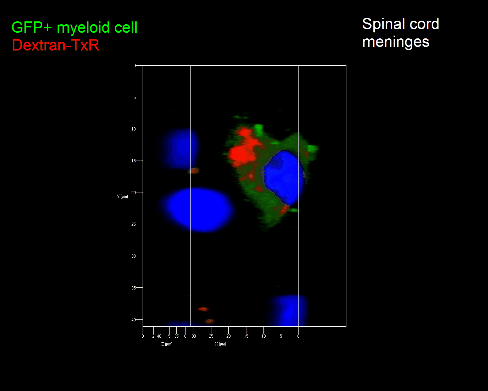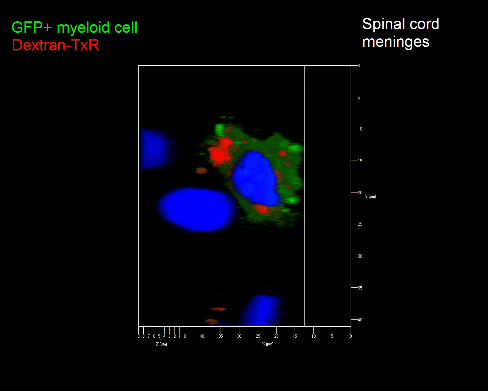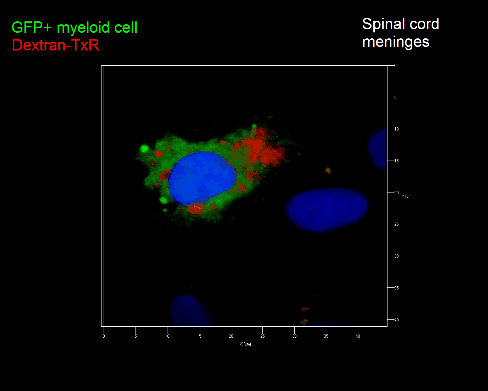
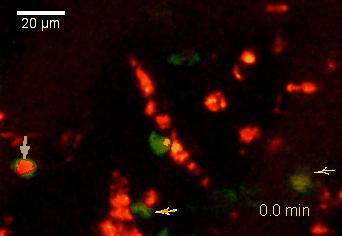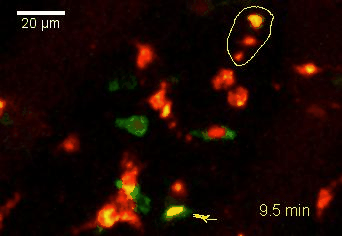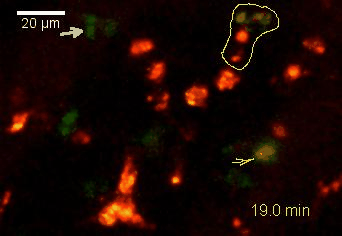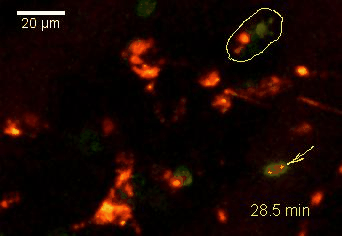
Meningeale Makrophagen nehmen sehr effizient Makromoleküle auf (z.B. fluoreszentes Dextran (Animation 3 und 4) und lösliche Antigene. Diese Eigenschaft kann man sich zunutze machen, um die Zellen im Tier zu markieren und ihre Interaktion mit T-Zellen durch intravitale 2-Photonenmikroskopie im Rückenmark zu verfolgen.
Der Transfer von MBP-spezifischen T-Zellen führt zur Induktion einer EAE in Lewis Ratten. Sind diese T-Zellen mit dem doppelt fluoreszenten Reporter NFAT/H2B ausgestattet, kann man diese kurz vor Einsetzen der ersten klinischen Symptome in den Meningen des Rückenmarks (Animation 4) visualisieren. Nach der Extravasation aus den Blutgefäßen, kriechen die T-Zellen entlang der pialen Gefäße und treffen dort auf die meningealen Makrophagen. Nach Kontakt nicht aktivierter T-Zellen (grauer Pfeil) mit TxR-Dextran markierten Makrophagen verlagert sich das zytosolische NFAT in den Zellkern (gelber Kreis). Dadurch kann man Echtzeitmessungen von T-Zellaktivierung im lebenden Tier durchführen und diese quantifizieren.
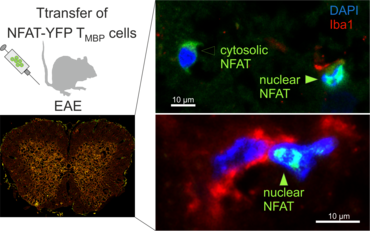
Die Modellierung von T-Zell vermittelter Autoimmunität in transgenen Ratten
Antigenrezeptoren, die auf der Oberfläche von T-Zellen exprimiert werden, sind im Genom in speziellen Segmenten organisiert, die während der T-Zellentwicklung durch V(D)J Rekombination zu funktionellen Einheiten zusammengefügt werden.
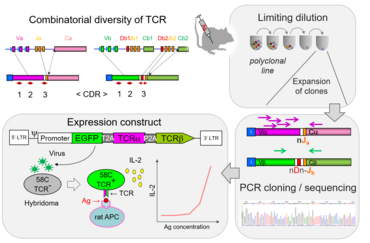
In einem normalen Immunrepertoire erkennen jeweils nur wenige T-Zellen ein spezifisches Antigen. Durch genetische Manipulation wurden Mäuse generiert, die ein T-Zellrepertoire besitzen, das spezifisch für ein einziges Antigen ist. Damit wurden diese T-Zellrezeptor transgenen Mäuse zu einem sehr nützlichen Werkzeug in der immunologischen Forschung. Wir arbeiten an der Erschaffung von T-Zellrezeptor (TZR)-transgenen Lewis Ratten für verschiedene Antigene, darunter auch Autoantigene die im Nervengewebe exprimiert werden. Für die Klonierung der spezifische T-Zellrezeptoren, müssen zuerst DNA Sequenzen für deren α- und β-Kette identifiziert werden. Dazu verwenden wir T-Zellkulturtechniken, um klonale Populationen zu erzeugen. Die so erhaltenen Sequenzen werden in lentivirale Expressionsvektoren kloniert und in TZR-negativen Hybridomlinien auf ihre Antigenreaktivität getestet. Lentiviren mit funktionellem TZR werden dann durch Transgenese von Rattenembryos im Präimplantationsstadium zur Generierung der transgenen Rattenstämme verwendet.
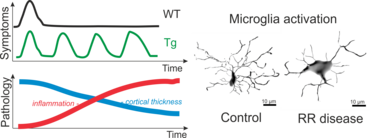
Vor kurzem konnten wir mit Hilfe dieser Techniken transgene Lewis Ratten generiert, die einen TZR spezifisch für das β-Synukleinprotein der Ratte exprimieren (Lodygin, Hermann et al., 2019). Mit diesem Rattenmodell konnten wir zeigen, dass T-Zellen, die ein neuronales Autoantigen (β-Synuklein) erkennen, eine Entzündung in der grauen Substanz des ZNS hervorrufen. Im Gegensatz dazu lösen Myelin-spezifischen T-Zellen eine Entzündung in der weißen Substanz des ZNS aus. Außerdem konnten wir in unseren transgenen Tieren zeigen, dass wiederholte Attacken von CD4 T-Effektorzellen mit einer bleibenden Gliose, neuronalen Schäden und kortikaler Gehirnatrophie einhergehen. Somit kann dieses neue Tiermodell dazu verwendet werden, Mechanismen in autoimmunen Erkrankungen des ZNS zu verstehen, die mit fortschreitenden Schädigungen einhergehen.
Die Regulation der Ca2+ Signaltransduktion in T-Zellen
Nach Bindung von Molekülen an Immunrezeptoren, wie z.B. dem T-Zellrezeptor, erfolgt eine Erhöhung der Ca2+ Konzentration im Zytosol der Zelle. Diese Ca2+-Erhöhung aktiviert wiederum verschiedene Transkriptionsfaktoren, wie z.B. NFAT, CREB und NF-kappaB, welche die Expression von Genen regulieren, die für die Funktion von T-Zellen essentiell sind. Der Anstieg an intrazellulärem Ca2+ erfolgt hauptsächlich durch „store-operated“ Kalziumeinstrom (SOCE) und „calcium-release-activated“ Kalziumkanäle (CRAC).
Das endoplasmatische Retikulum (ER) und saure Endosomen/Lysosomen sind intrazelluläre Kalziumspeicher. Da das ER von T-Zellen relativ klein ist, bewirkt eine Ca2+ Freisetzung daraus nur eine moderate und transiente Erhöhung von zytoplasmatischem Kalzium. Die damit einhergehende Entleerung der Kalziumspeicher führt zur Aktivierung der CRAC Kanäle in der Plasmamembran und bewirkt einen massiven Einstrom von extrazellulärem Ca2+.
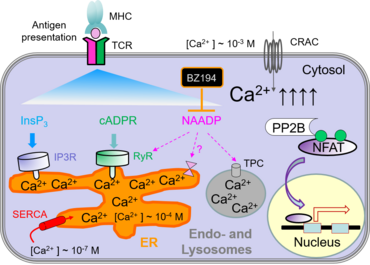
Die Entleerung der Kalziumspeicher kann auf verschiedene Arten ausgelöst werden, z.B. durch „second messenger“ wie Inositol-1,4,5-triphosphat (InsP3), zyklische ADP Ribose (cADPR) oder Nicotinsäure-adenindinukleotid-phosphat (NAADP). Diese „second messenger“ Moleküle werden nach Aktivierung des T-Zellrezeptors und Signaltransduktion durch Tyrosinkinasen gebildet. Vor kurzem konnten wir BZ194 als einen Inhibitor von NAADP identifizieren, der in der frühen Phase der T-Zellaktivierung wirksam ist (Dammermann et al., PNAS 2009). Die klinischen Symptome in Lewis Ratten konnten in aktiver und Transfer- EAE sowohl durch präventive als auch therapeutische Gabe von BZ194 verbessert werden. Damit könnte der NAADP -> Ca2+ Signalweg einen neuartigen Angriffspunkt für die Behandlung von Autoimmunerkrankungen darstellen (Cordiglieri et al., 2010).
Zurzeit untersuchen wir die Rolle anderer Ca2+ -freisetzender Kanäle und Molekule, z.B. die Ryanodinrezeptoren (RyR) in der EAE.
Kontakt

Kontaktinformationen
- Telefon: +49 551 3961141
- E-Mail-Adresse: dmitri.lodygin(at)med.uni-goettingen.de
Relevante Publikationen
Lodygin D+, Hermann M+, Schweingruber N, Flügel-Koch C, Watanabe T, Schlosser C, Merlini A, Körner H, Chang H-F, Fischer HJ, Reichardt HM, Zagrebelsky M, Mollenhauer B, Frahm J, Stadelmann C, Kügler S, Fitzner D, Haberl M, Odoardi F* & Flügel A*+equal contribution, * co-senior authors
β-Synuclein reactive T cells induce autoimmune CNS grey matter degeneration.
Nature, 566: 503-508. PMID 30787438.
Diercks BP, Werner R, Weidemüller P, Czarniak F, Hernandez L, Lehmann C, Rosche A, Krüger A, Kaufmann U, Vaeth M, Failla AV, Zobiak B, Kandil FI, Schetelig D, Ruthenbeck A, Meier C, Lodygin D, Flügel A, Ren D, Wolf IMA, Feske S, Guse AH.
ORAI1, STIM1/2, and RYR1 shape subsecond Ca2+ microdomains upon T cell activation.
Sci Signal, 11 (2018): pii: eaat0358. doi: 10.1126/scisignal.aat0358.
Lodygin D, Flügel A.
Intravital real-time analysis of T-cell activation in health and disease.
Cell Calcium, 64 (2017): 118-129.
Schläger C, Körner H, Krueger M, Vidoli S, Haberl M, Mielke D, Brylla E, Issekutz T, Cabañas C, Nelson PJ, Ziemssen T, Rohde V, Bechmann I, Lodygin D, Odoardi F, Flügel A.
Effector T-cell trafficking between the leptomeninges and the cerebrospinal fluid.
Nature 530 (2016): 349-353.
Wolf IM, Diercks BP, Gattkowski E, Czarniak F, Kempski J, Werner R, Schetelig D, Mittrücker HW, Schumacher V, von Osten M, Lodygin D, Flügel A, Fliegert R, Guse AH.
Frontrunners of T cell activation: Initial, localized Ca2+ signals mediated by NAADP and the type 1 ryanodine receptor.
Sci Signal 8 (2015): ra102. doi: 10.1126/scisignal.aab0863.
Lodygin D, Odoardi F, Schläger C, Körner H, Kitz A, Nosov M, van den Brandt J, Reichardt HM, Haberl M, Flügel A.
A combination of fluorescent NFAT and H2B sensors uncovers dynamics of T cell activation in real time during CNS autoimmunity.
Nat Med 19 (2013): 784-790.