Kontakt

Kontaktinformationen
- Telefon: +49 551 3961139
- E-Mail-Adresse: francesca.odoardi(at)med.uni-goettingen.de
Relevante Publikationen
Hosang L, Löhndorf A, Dohle W, Rosche A, Marry S, Diercks B-P, Müller-Kirschbaum LC, Flügel LT, Potter BVL, Odoardi F, Guse AH*, Flügel A*.
2-Methoxyestradiol-3,17-O,O-bis-sulfamate inhibits store-operated Ca2+ entry in T lymphocytes and prevents experimental autoimmune encephalomyelitis.
Biochim Biophys Acta Mol Cell Res (2023), 1870: 119485. doi: 10.1016/j.bbamcr.2023.119485. *equal contribution. PMID 37150482.
Merlini A, Haberl M, Strauß J, Hildebrand L, Genc N, Franz J, Chilov D, Alitalo K, Flügel-Koch C, Stadelmann C, Flügel A*, Odoardi F*
Distinct roles of the meningeal layers in CNS autoimmunity.
Nat Neurosci (2022), 25: 887-899. doi: 10.1038/s41593-022-01108-3. *equal contribution. PMID 35773544.
Hosang L, Cugota Canals R, van der Flier FJ, Hollensteiner J, Daniel R, Flügel A* and Odoardi F*
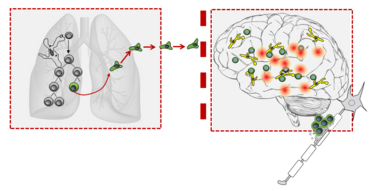
The lung microbiome regulates brain autoimmunity.
Nature (2022), 603: 138-144. doi: 10.1038/s41586-022-04427-4. *equal contribution. PMID 35197636.
Lodygin D+, Hermann M+, Schweingruber N, Flügel-Koch C, Watanabe T, Schlosser C, Merlini A, Körner H, Chang H-F, Fischer HJ, Reichardt HM, Zagrebelsky M, Mollenhauer B, Frahm J, Stadelmann C, Kügler S, Fitzner D, Haberl M, Odoardi F* & Flügel A*+equal contribution, * co-senior authors
β-Synuclein reactive T cells induce autoimmune CNS grey matter degeneration.
Nature, 566: 503-508. PMID 30787438.
Schläger C, Körner H, Krueger M, Vidoli S, Haberl M, Mielke D, Brylla E, Issekutz T, Cabañas C, Nelson PJ, Ziemssen T, Rohde V, Bechmann I, Lodygin D, Odoardi F, Flügel A.
Effector T-cell trafficking between the leptomeninges and the cerebrospinal fluid.
Nature 530 (2016): 349-353.
Lodygin D, Odoardi F, Schläger C, Körner H, Kitz A, Nosov M, van den Brandt J, Reichardt HM, Haberl M, Flügel A.
A combination of fluorescent NFAT and H2B sensors uncovers dynamics of T cell activation in real time during CNS autoimmunity.
Nat Med 19 (2013): 784-790.
Odoardi F, Sie C, Streyl K, Ulaganathan VK, Schläger C,Lodygin D, Heckelsmiller K, Nietfeld W, Ellwart J, Klinkert WE, Lottaz C, Nosov M, Brinkmann V, Spang R, Lehrach H, Vingron M, Wekerle H, Flügel-Koch C, Flügel A.
T cells become licensed in the lung to enter the central nervous system.
Nature 488 (2012): 675-679
C. Cordiglieri, F. Odoardi, B. Zhang, M. Nebel, N. Kawakami, W.E.F. Klinkert, D. Lodygin, F. Lühder, E. Breunig, D. Schild, V. Kumar, K. Dornmair, W. Dammermann; B.V.L. Potter, A.H. Guse, A. Flügel.
NAADP-mediated Ca2+ signaling in effector T cells regulates autoimmunity of the nervous system.
Brain 133 (2010): 1930-43.
I. Bartholomäus, N. Kawakami, F. Odoardi, C. Schläger, D. Miljkovic, J.W. Ellwart, W.E. Klinkert, T.B. Issekutz, C. Flügel-Koch, H. Wekerle, A. Flügel.
Effector T cell interactions with meningeal vascular structures in nascent autoimmune CNS lesions.
Nature 462 (2009):94-8.
N. Müller, J. van den Brandt, F. Odoardi, D. Tischner, J. Herath, A. Flügel, H.M. Reichardt.
CD28 superagonistic antibodies elicit two functionally distinct waves of T cell activation.
Journal of Clinical Investigation 118(2008):1405-1416.
F. Odoardi, N. Kawakami, W.E.F. Klinkert, H. Wekerle, A. Flügel.
Blood-born soluble protein antigen intensifies T cell activation in autoimmune CNS lesions and exacerbates clinical disease.
Proceedings of the National Academy of Sciences of the United States of America 104 (2007): 18625-18630.
F. Odoardi, N. Kawakami, Z. Li, C. Cordiglieri, K. Streyl, M. Nosov, W.E.F. Klinkert, J.W. Ellwart, J. Bauer, H. Lassmann, H. Wekerle, A. Flügel.
Instant effect of soluble autoantigen on effector T cells in peripheral immune organs during immunotherapy of autoimmune encephalomyelitis.
Proceedings of the National Academy of Sciences of the United States of America 16 (2007): 920-25.
N. Kawakami, F. Odoardi, T. Ziemssen, M. Bradl, T. Ritter, O. Neuhaus, H. Lassmann, H. Wekerle, A. Flügel.
Autoimmune CD4+ T cell memory: Life long persistence of encephalitogenic T cell clones in healthy immune repertoires.
Journal of Immunology, 175 (2005):69-81.
N. Kawakami, U.V. Nägerl, F. Odoardi, T. Bonhoeffer, H. Wekerle, A. Flügel.
Live imaging of effector cell trafficking and autoantigen recognition within the unfolding autoimmune encephalomyelitis lesion.
Journal of Experimental Medicine, 201 (2005): 1805-14.
N. Kawakami, S. Lassmann, Z. Li, F. Odoardi, T. Ritter, T. Ziemssen, W.E.F. Klinkert, J.W. Ellwart, M. Bradl, K. Krivacic, H. Lassmann, R.M. Ransohoff, H-D. Volk, H. Wekerle, C. Linington, A. Flügel.
The activation status of neuroantigen-specific T cells in the target organ determines the clinical outcome of autoimmune encephalomyelitis.
Journal of Experimental Medicine 199 (2004): 185-197.